Portada del sitio > Química - 2Bach > 7 - Reacciones de transferencia de electrones. Oxidación-reducción (...)
7 - Reacciones de transferencia de electrones. Oxidación-reducción (redox)
Todos los Ejercicios del Tema
Artículos de esta sección
-
Solución
Al reaccionar estaño con ácido nítrico, el estaño se oxida a dióxido de estaño y se desprende óxido de nitrógeno (II). a) Escribir la ecuación ajustada de esta reacción, por el método del ion-electrón. b) Si el estaño forma parte de una aleación y de 1 kg de la misma se obtienen 0,382 kg de dióxido de estaño, hallar el porcentaje de estaño en la aleación.
(Pesos atómicos: N= 14, Sn= 118,7, O= 16, H= 1).
-
Dibuja la pila formada por un ánodo de cinc y un cátodo deSolución
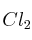 , ambos sumergidos en una disolución de KCl (1 M), y escribe el diagrama de la pila.
, ambos sumergidos en una disolución de KCl (1 M), y escribe el diagrama de la pila. -
Determina cuál es el ánodo y cuál es el cátodo si construimos una pila galvánica con un electrodo de aluminio y otro de plata, sumergidos en sendas disoluciones de sus iones. Escribe el diagrama de la pila y calcula su potencial estándar.Solución
-
Solución
A partir de los datos de potenciales estándar de reducción, decide si el proceso
 es espontáneo y cuál será la
es espontáneo y cuál será la  .
.Datos:
 ;
; 
-
Se electroliza una disolución de nitrato de plata durante 2,5 h con una corriente constante. Después del proceso se han depositado 15,1 g de plata. Calcula la intensidad de la corriente.Solución
0 | 10


