SELECTIVIDAD Septiembre 2012
Artículos de esta sección
-
Formula o nombra los compuestos siguientes: a) Hidróxido de estaño (IV); b) Perclorato de sodio; c) Propino; d)Solución
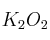 ; e)
; e) 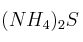 ; f)
; f) 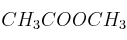
-
Solución
Indica razonadamente:
a) La posición en el sistema periódico y el estado de oxidación más probable de un elemento cuyos electrones de mayor energía poseen la configuración
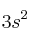 .
.b) Si un elemento de configuración electrónica de su capa de valencia
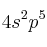 es un metal o no metal.
es un metal o no metal.c) Por qué en los halógenos la energía de ionización disminuye a medida que aumenta el número atómico del elemento.
-
Solución
A 25ºC la constante del equilibrio de solubilidad del
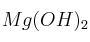 sólido es,
sólido es, 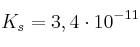 .
.a) Establece la relación que existe entre la constante
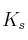 y la solubilidad (s) del
y la solubilidad (s) del 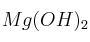 .
.b) Explica, razonadamente, cómo se podría disolver, a 25 ºC y mediante procedimientos químicos, un precipitado de
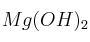 .
.c) ¿Qué efecto tendría sobre la solubilidad del
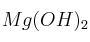 a 25 ºC la adición de cloruro de magnesio? Razona la respuesta.
a 25 ºC la adición de cloruro de magnesio? Razona la respuesta. -
Solución
Un litro de
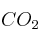 se encuentra en condiciones normales. Calcula:
se encuentra en condiciones normales. Calcula:a) El número de moles que contiene.
b) El número de moléculas de
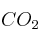 presentes.
presentes.c) La masa en gramos de una molécula de
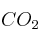 .
.Masas atómicas: C=12; O=16.
-
Solución
El ácido sulfúrico concentrado reacciona con el bromuro de potasio para dar bromo, dióxido de azufre, sulfato de potasio y agua.
a) Escribe y ajusta la ecuación molecular por el método del ion-electrón.
b) Calcula los gramos de bromo que se producirán cuando se traten 50 g de bromuro de potasio con exceso de ácido sulfúrico.
Masas atómicas: K=39; Br=80.
-
Solución
a) Calcula la variación de entalpía de formación del amoniaco, a partir de los siguientes datos de energías de enlace: E (H-H) = 436 kJ/mol; E (N-H) = 389 kJ/mol; E (N≡N) = 945 kJ/mol.
b) Calcula la variación de energía interna en la formación del amoniaco a la temperatura de 25 ºC.
Dato: R=8,31 J·K-1·mol-1.
-
Formula o nombra los compuestos siguientes: a) Hidruro de magnesio; b) Ácido nítrico; c) 1,2-Dimetilbenceno; d)Solución
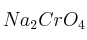 ; e) CsCl; f)
; e) CsCl; f) 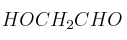
-
Solución
Dadas las siguientes moléculas:
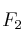 ;
; 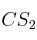 ;
; 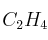 ;
; 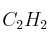 ;
; 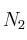 ;
; 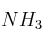 , justifica mediante la estructura de Lewis en qué moléculas:
, justifica mediante la estructura de Lewis en qué moléculas:a) Todos los enlaces son simples.
b) Existe algún enlace doble.
c) Existe algún enlace triple.
-
Solución
En una reacción endotérmica:
a) Dibuja el diagrama entálpico de la reacción.
b) ¿Cuál es mayor, la energía de activación directa o la inversa?
c) ¿Cómo afectará al diagrama anterior la adición de un catalizador?
-
Solución
Dados los siguientes compuestos:
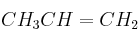 y
y 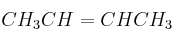 , elige el más adecuado para cada caso (justifica la respuesta):
, elige el más adecuado para cada caso (justifica la respuesta):a) El compuesto reacciona con
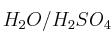 para dar otro compuesto que presenta isomería óptica.
para dar otro compuesto que presenta isomería óptica.b) La combustión de 2 moles de compuesto producen 6 moles de
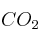 .
.c) El compuesto reacciona con HBr para dar un compuesto que no presenta isomería óptica.
0 | 10


