SELECTIVIDAD Septiembre 2010
Artículos de esta sección
-
Escribir las fórmulas de los productos formados en la reacción del propeno con cada una de las siguientes sustancias: a)Solución
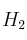 ; b)
; b) 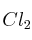 ; c) HCN; d) HCl; e)
; c) HCN; d) HCl; e) 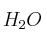 (en medio ácido). ¿Qué tipo de reacción se produce?
(en medio ácido). ¿Qué tipo de reacción se produce? -
Solución
a) Dos átomos tienen las siguientes configuraciones electrónicas
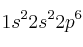 y
y 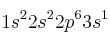 . La primera energía de ionización de uno es 2080 kJ/mol y la del otro 496 kJ/mol. Asigne cada uno de estos valores a cada una de las configuraciones electrónicas y justifique la elección.
. La primera energía de ionización de uno es 2080 kJ/mol y la del otro 496 kJ/mol. Asigne cada uno de estos valores a cada una de las configuraciones electrónicas y justifique la elección.b) La segunda energía de ionización del átomo de helio ¿será mayor, menor o igual que la energía de ionización del átomo de hidrógeno? Razone la respuesta.
-
Solución
En un recipiente cerrado se establece el siguiente equilibrio:
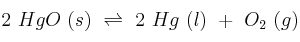 ;
; 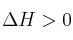
a) Escriba las expresiones de las constantes
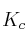 y
y 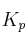 .
.b) ¿Cómo afecta al equilibrio un aumento de la presión parcial de oxígeno?
c) ¿Qué le ocurrirá al equilibrio cuando se aumente la temperatura?c
-
Solución
Dados los compuestos orgánicos:
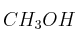 ,
, 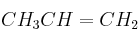 , y
, y 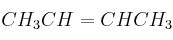 , indique razonadamente:
, indique razonadamente:a) El que puede formar enlaces de hidrógeno.
b) Los que pueden experimentar reacciones de adición.
c) El que presenta isomería geométrica.
-
Solución
Se dispone de una disolución acuosa de hidróxido de bario de pH = 12. Calcule:
a) Los gramos de hidróxido de bario disueltos en 650 mL de esa disolución.
b) El volumen de ácido clorhídrico 0,2 M que es necesario para neutralizar los 650 mL de la disolución anterior.
Masas atómicas: O = 16; H = 1; Ba = 137.
-
Solución
El cloruro de sodio reacciona con nitrato de plata precipitando totalmente cloruro de plata y obteniéndose además nitrato de sodio. Calcule:
a) La masa de cloruro de plata que se obtiene a partir de 100 mL de disolución de nitrato de plata 0,5 M y de 100 mL de disolución de cloruro de sodio 0,4 M.
b) Los gramos del reactivo en exceso.
Masas atómicas: O = 16; Na = 23; N = 14; Cl = 35,5; Ag = 108.
-
Formule o nombre los compuestos siguientes: a) Cromato de plata ; b) Óxido de estaño (IV) ; c) But-1-eno ; d)Solución
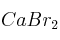 ; e)
; e) 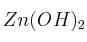 ; f)
; f) 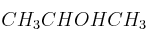
-
Solución
Exprese en moles las siguientes cantidades de dióxido de carbono:
a) 11,2 L, medidos en condiciones normales.
b)
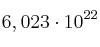 moléculas.
moléculas.c) 25 L medidos a 27 ºC y 2 atmósferas.
Dato: R = 0,082
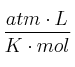
-
Solución
a) Justifique si los siguientes procesos son redox:
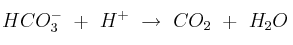
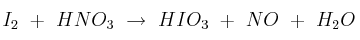
b) Escriba las semiecuaciones de oxidación y de reducción en el que corresponda.
-
Solución
Justifique, mediante las reacciones correspondientes:
a) Qué le ocurre al equilibrio de hidrólisis que experimenta el
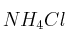 en disolución acuosa, cuando se añade
en disolución acuosa, cuando se añade 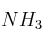 .
.b) El comportamiento anfótero del
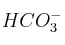 en disolución acuosa.
en disolución acuosa.c) El carácter ácido o básico del
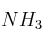 y del
y del 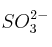 en disolución acuosa.
en disolución acuosa.
0 | 10


