SELECTIVIDAD Junio 2014
Artículos de esta sección
-
Formula o nombra los siguientes compuestos: a) Fluoruro de amonio ; b) Hidróxido de cadmio ; c) 1-bromo-2-cloropropano ; d) PbO ; e)Solución
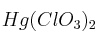 ; f)
; f) 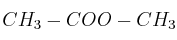
-
Solución
Responde a las siguientes cuestiones justificando la respuesta:
a) ¿En qué grupo y en qué periodo se encuentra el elemento cuya configuración electrónica termina en
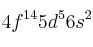 ?
?b) ¿Es posible el siguiente conjunto de números cuánticos (1, 1, 0, 1/2)?
c) ¿La configuración electrónica
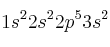 pertenece a un átomo en su estado fundamental?
pertenece a un átomo en su estado fundamental? -
Solución
En el equilibrio:
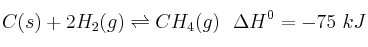 . Predice razonadamente cómo se modificará el equilibrio cuando se realicen los siguientes cambios:
. Predice razonadamente cómo se modificará el equilibrio cuando se realicen los siguientes cambios:a) Una disminución de la temperatura.
b) La adición de C(s).
c) Una disminución de la presión de
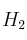 , manteniendo la temperatura constante.
, manteniendo la temperatura constante. -
Solución
Dado el siguiente compuesto
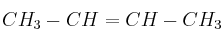 , di, justificando la respuesta, si las siguientes afirmaciones son verdaderas o falsas:
, di, justificando la respuesta, si las siguientes afirmaciones son verdaderas o falsas:a) El compuesto reacciona con
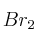 para dar dos compuestos isómeros geométricos.
para dar dos compuestos isómeros geométricos.b) El compuesto reacciona con HCl para dar un compuesto que no presenta isomería óptica.
c) El compuesto reacciona con
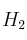 para dar
para dar 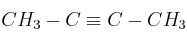 .
. -
Solución
Para la obtención del tetracloruro de carbono según:
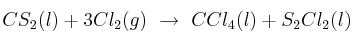 :
:a) Calcula el calor de reacción, a presión constante, a 25 ºC y en condiciones estándar.
b) ¿Cuál es la energía intercambiada en la reacción anterior, en las mismas condiciones, cuando se forma un litro de tetracloruro de carbono cuya densidad es 1,4 g/mL?
Datos:
![\Delta H_f^0[CS_2(l)] = 89,70\ kJ/mol \Delta H_f^0[CS_2(l)] = 89,70\ kJ/mol](local/cache-TeX/8b2f589700663f467dafdacb3359026e.png) ;
; ![\Delta H_f^0[CCl_4(l)] = -135,40\ kJ/mol \Delta H_f^0[CCl_4(l)] = -135,40\ kJ/mol](local/cache-TeX/9bea697cf75cffedef11777a6f9d718e.png) ;
; ![\Delta H_f^0[S_2Cl_2(l)] = -59,80\ kJ/mol \Delta H_f^0[S_2Cl_2(l)] = -59,80\ kJ/mol](local/cache-TeX/cc5fa7d0201585381e2b07f14bb8f47b.png) ; Masas atómicas: C = 12 ; Cl = 35,5
; Masas atómicas: C = 12 ; Cl = 35,5 -
Solución
Calcula:
a) El pH de la disolución que resulta de mezclar 250 mL de HCl 0,1 M con 150 mL de NaOH 0,2 M. Supón que los volúmenes son aditivos.
b) La riqueza de un hidróxido de sodio comercial, si 30 g del mismo necesitan 50 mL de
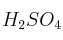 3 M para su neutralización.
3 M para su neutralización.Datos: Masas atómicas H = 1 ; O = 16 ; Na = 23
-
Formula o nombra los siguientes compuestos: a) Ácido selénico ; b) Fosfato de cobalto(II) ; c) Ciclopenteno ; d)Solución
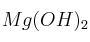 ; e)
; e) 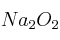 ; f)
; f) 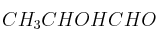
-
Solución
La fórmula empírica de un compuesto orgánico es
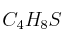 . Si su masa molecular es 88, determina:
. Si su masa molecular es 88, determina:a) Su fórmula molecular.
b) El número de átomos de hidrógeno que hay en 25 g de dicho compuesto.
c) La presión que ejercerán 2 g del compuesto en estado gaseoso a 120 ºC, en un recipiente de 1,5 L.
Datos: C = 12; H = 1; S = 32; R =
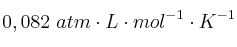
-
Solución
a) Deduce la geometría de las moléculas
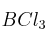 y
y 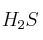 aplicando la Teoría de Repulsión de los Pares de Electrones de la Capa de Valencia.
aplicando la Teoría de Repulsión de los Pares de Electrones de la Capa de Valencia.b) Explica si las moléculas anteriores son polares.
c) Indica la hibridación que posee el átomo central.
-
Solución
Indica, razonadamente, si cada una de las siguientes proposiciones es verdadera o falsa:
a) De acuerdo con la teoría de Brönsted-Lowry el carácter básico del amoniaco, en disoluciones acuosas, se debe a que acepta un grupo
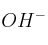 de la molécula de agua.
de la molécula de agua.b) Si el pH de una disolución de un ácido monoprótico fuerte es 2,17 la concentración molar de la disolución respecto a dicho ácido estará comprendida entre 0,001 y 0,01.
c) En disoluciones acuosas, el ion
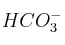 se comporta como un electrolito anfótero.
se comporta como un electrolito anfótero.
0 | 10


