SELECTIVIDAD Junio 2010
Artículos de esta sección
-
Formule o nombre los compuestos siguientes: a) Nitrito de plata; b) Hidróxido de magnesio; c) 1,1-Dicloroetano; d)Solución
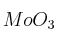 ; e)
; e) 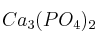 ; f)
; f) 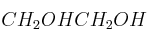
-
Solución
Supongamos que los sólidos cristalinos NaF, KF y LiF cristalizan en el mismo tipo de red.
a) Escriba el ciclo de Born-Haber para el NaF.
b) Razone cómo varía la energía reticular de las sales mencionadas.
c) Razone cómo varían las temperaturas de fusión de las citadas sales.
-
Solución
Se dispone de una disolución acuosa saturada de
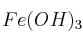 , compuesto poco soluble.
, compuesto poco soluble.a) Escriba la expresión del producto de solubilidad para este compuesto.
b) Deduzca la expresión que permite conocer la solubilidad del hidróxido a partir del producto de solubilidad.
c) Razone cómo varía la solubilidad del hidróxido al aumentar el pH de la disolución.
-
Solución
Razone si las siguientes afirmaciones son verdaderas o falsas:
a) La entalpía de formación estándar del mercurio líquido, a 25 ºC, es cero.
b) Todas las reacciones químicas en que
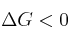 son muy rápidas.
son muy rápidas.c) A -273 ºC la entropía de una sustancia cristalina pura es cero.
-
Solución
El gas cloro se puede obtener por reacción de ácido clorhídrico con ácido nítrico, produciéndose simultáneamente dióxido de nitrógeno y agua.
a) Ajuste la ecuación iónica y molecular por el método del ion-electrón.
b) Calcule el volumen de cloro obtenido, a 17 ºC y 720 mm de mercurio, cuando reaccionan 100 mL de una disolución de ácido clorhídrico 0,5 M con ácido nítrico en exceso.
Dato:
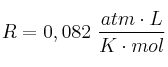
-
Solución
Disponemos de dos matraces: uno contiene 50 mL de una disolución acuosa de HCl 0,10 M, y el otro, 50 mL de una disolución acuosa de HCOOH diez veces más concentrado que el primero. Calcule:
a) El pH de cada una de las disoluciones.
b) El volumen de agua que se debe añadir a la disolución más ácida para que el pH de las dos sea el mismo.
Dato:
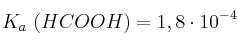
-
Formule o nombre los siguientes compuestos: a) Peróxido de rubidio; b) Hidrogenocarbonato de calcio; c) Butanona; d)Solución
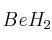 ; e)
; e) 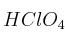 ; f)
; f) 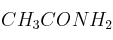
-
Solución
Un tubo de ensayo contiene 25 mL de agua. Calcule:
a) El número de moles de agua.
b) El número total de átomos de hidrógeno.
c) La masa en gramos de una molécula de agua.
Datos: Densidad del agua = 1 g/mL. Masas atómicas: O = 16; H = 1
-
Solución
a) Escriba la configuración electrónica de los iones
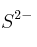 y
y 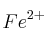 .
.b) Indique un catión y un anión que sean isoelectrónicos con
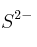 .
.c) Justifique por qué la segunda energía de ionización del magnesio es mayor que la primera.
-
Solución
a) Ordene de menor a mayor acidez las disoluciones acuosas de igual concentración de
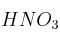 , NaOH y
, NaOH y 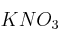 . Razone su respuesta.
. Razone su respuesta.b) Se tiene un ácido fuerte HA en disolución acuosa. Justifique qué le sucederá al pH de la disolución al añadir agua.
0 | 10


