SELECTIVIDAD Junio 2011
Artículos de esta sección
-
Formule o nombre los compuestos siguientes: a) Óxido de níquel (III) ; b) Hidróxido de estroncio ; c) Nitrobenceno ; d)Solución
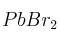 ; e)
; e) 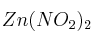 ; f)
; f) 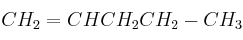
-
Solución
a) Escriba las configuraciones electrónicas de los átomos Na y Mg.
b) Justifique por qué el valor de la primera energía de ionización es mayor para el magnesio que para el sodio.
c) Justifique por qué el valor de la segunda energía de ionización es mayor para el átomo de sodio que para el de magnesio.
-
Solución
Al calentar yodo en una atmósfera de dióxido de carbono, se produce monóxido de carbono y pentaóxido de diyodo:
Justifique el efecto que tendrán los cambios que se proponen: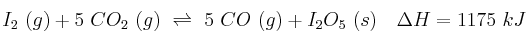
a) Disminución del volumen sobre el valor de la constante
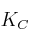
b) Adición de
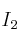 sobre la cantidad de CO
sobre la cantidad de COc) Reducción de la temperatura sobre la cantidad de
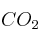
-
Solución
Dada la siguiente transformación química:
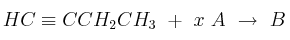
Justifique si las siguientes afirmaciones son verdaderas o falsas:
a) Cuando x = 2 y A =
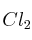 el producto B presenta isomería geométrica.
el producto B presenta isomería geométrica.b) Cuando x = 1 y A =
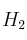 el producto B presenta isomería geométrica.
el producto B presenta isomería geométrica.c) Cuando x = 1 y A =
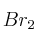 el producto B presenta isomería geométrica.
el producto B presenta isomería geométrica. -
Solución
A 25ºC una disolución acuosa de amoniaco contiene 0,17 g de este compuesto por litro y se encuentra disociado en un 4,3
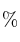 . Calcule:
. Calcule:a) La concentración de iones hidroxilo y amonio.
b) La constante de disociación.
Masas atómicas: N = 14 ; H = 1.
-
Solución
En disolución acuosa el ácido sulfúrico reacciona con cloruro de bario precipitando totalmente sulfato de bario y obteniéndose además ácido clorhídrico. Calcule:
a) El volumen de una disolución de ácido sulfúrico de 1,84 g/mL de densidad y 96
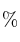 de riqueza en masa, necesario para que reaccionen totalmente 21,6 g de cloruro de bario.
de riqueza en masa, necesario para que reaccionen totalmente 21,6 g de cloruro de bario.b) La masa de sulfato de bario que se obtendrá.
Masas atómicas: H = 1 ; O = 16 ; S = 32 ; Ba = 137,4 ; Cl = 35,5
-
Formule o nombre los compuestos siguientes: a) Ácido hipobromoso ; b) Hidróxido de cobre (II) ; c) Ácido 2-aminopropanoico ; d)Solución
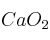 ; e)
; e) 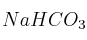 ; f)
; f) 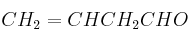
-
Solución
a) ¿Cuál es la masa, expresada en gramos, de un átomo de calcio?
b) ¿Cuántos átomos de cobre hay en 2,5 g de ese elemento?
c) ¿Cuántas moléculas hay en una muestra que contiene 20 g de tetracloruro de carbono?
Masas atómicas: C = 12 ; Ca = 40 ; Cu = 63,5 ; Cl = 35,5.
-
Solución
En la tabla siguiente se indican los potenciales estándar de reducción de distintos pares en disolución acuosa:
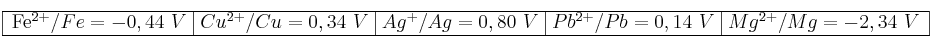
a) De estas especies, razone: ¿Cuál es la más oxidante? ¿Cuál es la más reductora?
b) Si se introduce una barra de plomo en una disolución acuosa de cada una de las siguientes sales:
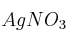 ,
, 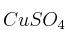 ,
, 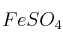 y
y 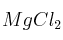 , ¿en qué casos se depositará una capa de otro metal sobre la barra de plomo? Justifique la respuesta.
, ¿en qué casos se depositará una capa de otro metal sobre la barra de plomo? Justifique la respuesta. -
Solución
Al disolver en agua las siguientes sales: KCl,
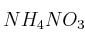 y
y 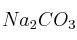 , justifique mediante las reacciones correspondientes qué disolución es:
, justifique mediante las reacciones correspondientes qué disolución es:a) Ácida.
b) Básica.
c) Neutra.
0 | 10


