4 - Cinética Química
Artículos de esta sección
-
Solución
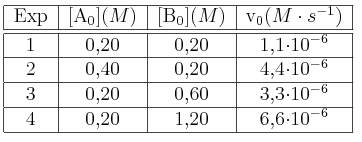
Para estudiar la cinética de la reacción
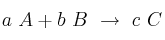 se han realizado cuatro medidas con distintos valores de concentración inicial:
se han realizado cuatro medidas con distintos valores de concentración inicial:Escribe la ecuación de velocidad de la reacción y calcula su constante de velocidad.
-
La conversión del ciclopropano en propeno en fase gaseosa responde a una cinética de primer orden con una constante de velocidad deSolución
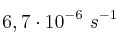 a una temperatura de 300 ºC. Calcula el período de semirreacción.
a una temperatura de 300 ºC. Calcula el período de semirreacción. -
A 20 ºC la constante de velocidad de un proceso de descomposición de una sustancia esSolución
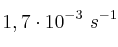 , mientras que su valor a 35 ºC es
, mientras que su valor a 35 ºC es 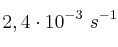 . ¿Cuál es la energía de activación del proceso? ¿Podemos asegurar que el orden total de la reacción es uno?
. ¿Cuál es la energía de activación del proceso? ¿Podemos asegurar que el orden total de la reacción es uno? -
Solución
Se determinó experimentalmente que la reacción
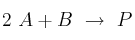 sigue la ecuación de velocidad
sigue la ecuación de velocidad ![v = k\ [B]^2 v = k\ [B]^2](local/cache-TeX/2d7071c3aa2dc2b8c2ad79f84d1b0847.png) . Contesta de forma razonada si las siguientes proposiciones son verdaderas o falsas:
. Contesta de forma razonada si las siguientes proposiciones son verdaderas o falsas:a) La velocidad de desaparición de B es la mitad de la velocidad de formación de P.
b) La concentración de P aumenta a medida que disminuyen las concentraciones de A y B.
c) El valor de la constante de velocidad es función solamente de la concentración inicial de B.
d) El orden total de la reacción es 3.
-
Solución
La reacción en fase gaseosa
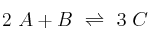 es una reacción elemental.
es una reacción elemental.a) Formula la expresión para la ecuación de la velocidad.
b) Indica las unidades de la velocidad de reacción y de la constante cinética.
c) Justifica cómo afecta a la velocidad de reacción un aumento de la temperatura, a volumen constante.
d) Justifica cómo afecta a la velocidad de reacción un aumento del volumen, a temperatura constante.
-
Solución
La reacción
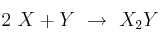 tiene órdenes parciales 2 y 1 respectivamente.
tiene órdenes parciales 2 y 1 respectivamente.a) ¿Cuál es el orden total de reacción? Escribe la ecuación de velocidad del proceso.
b) ¿Qué relación existe entre la velocidad de desaparición de X y la de aparición de
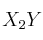 ?
?c) ¿En qué unidades se puede expresar la velocidad de esta reacción? ¿Y la constante de velocidad?
d) ¿De qué factor depende el valor de la constante de velocidad de esta reacción?
-
Solución
A un proceso le añadimos un catalizador negativo. Razona si las siguientes afirmaciones son verdaderas o falsas:
a) La variación de energía del proceso es negativa.
b) El orden total de reacción disminuye.
c) La velocidad de reacción disminuye.
d) Se modifica el mecanismo de reacción.