Portada del sitio > Química - 2Bach > 5 - Equilibrio Químico
5 - Equilibrio Químico
Ejercicios Modelo
Artículos de esta sección
-
En un reactor de 3,5 L y a 200 ºC se hace reaccionar nitrógeno e hidrógeno para dar amoniaco. En un momento determinado la composición del sistema es 0,249 moles de
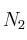 ,
, 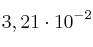 moles de
moles de 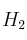 y
y 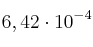 moles de
moles de 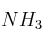 . Si la
. Si la 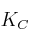 para la reacción a esa temperatura es 0,65, ¿habrá alcanzado el sistema el equilibrio? En caso de no estarlo, ¿hacia dónde evolucionará?
para la reacción a esa temperatura es 0,65, ¿habrá alcanzado el sistema el equilibrio? En caso de no estarlo, ¿hacia dónde evolucionará?


