Portada del sitio > Química - 2Bach > 3 - Termoquímica
3 - Termoquímica
Ejercicios de Ampliación
Artículos de esta sección
-
La entalpía de combustión de un hidrocarburo gaseoso
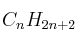 es -2220 kJ/mol. Calcule:
es -2220 kJ/mol. Calcule:a) La fórmula molecular de este hidrocarburo.
b) La energía desprendida en la combustión de 50 L de este gas, medidos a 25 ºC y 1 atm.
c) La masa de
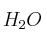 (l) que se obtendrá en la combustión anterior.
(l) que se obtendrá en la combustión anterior.Datos: R = 0,082 atm·L/K·mol ; Entalpías de formación (kJ/mol):
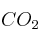 (g) = -393 ;
(g) = -393 ; 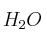 (l) = -286 ;
(l) = -286 ; 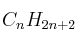 = -106 ; Masas atómicas: H = 1 ; O = 16.
= -106 ; Masas atómicas: H = 1 ; O = 16.


