02 - El Lenguaje de la Química
Artículos de esta sección
-
El dióxido de azufre reacciona con oxígeno gaseoso para formar trióxido de azufre.
a) ¿Cuántos gramos de trióxido de azufre podrán prepararse a partir de 23,5 g de dióxido de azufre?
b) ¿Qué volumen de oxígeno, medido en condiciones normales, se necesita para que reaccione todo el dióxido de azufre?
Datos: S = 32 ; O = 16
-
En la tostación de la pirita:
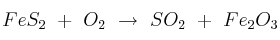 , determina:
, determina:a) La cantidad de
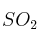 que se obtiene al tostar 2 toneladas de pirita de un
que se obtiene al tostar 2 toneladas de pirita de un  de riqueza, si el resto es ganga silícica.
de riqueza, si el resto es ganga silícica.b) El volumen de aire, medido a 298,15 K y 1 atm de presión, que se necesita para tostar dicha cantidad de mineral. (El porcentaje de
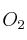 en el aire es del
en el aire es del 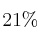 ).
).Datos: Fe = 55,85 ; S = 32 ; O = 16
-
El clorato de potasio se descompone por el calor en cloruro de potasio y oxígeno molecular. ¿Qué volumen de oxígeno, a 125 ºC y una atmósfera de presión, puede obtenerse por descomposición de 148 g de una muestra que contiene el
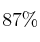 en peso de clorato potásico? ¿Cuántas moléculas de oxígeno se formarán?
en peso de clorato potásico? ¿Cuántas moléculas de oxígeno se formarán?Datos: Cl = 35,45 ; O = 16 ; K = 39,1
-
El cinc se disuelve en ácido sulfúrico formando sulfato de cinc e hidrógeno. ¿Qué masa de cinc puede disolverse en 500 mL de ácido sulfúrico al
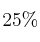 en peso y de densidad 1,09 g/mL? ¿Qué volumen de hidrógeno, medido en condiciones normales, se desprenderá en la reacción?
en peso y de densidad 1,09 g/mL? ¿Qué volumen de hidrógeno, medido en condiciones normales, se desprenderá en la reacción?Datos: Zn = 65,41 ; S = 32 ; O = 16 ; H = 1
-
La gasolina es una mezcla de hidrocarburos entre los que se encuentra el octano,
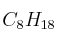 .
.a) Escribe la reacción ajustada para la combustión del octano.
b) Sabiendo que el porcentaje de oxígeno en el aire es del
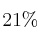 en volumen, calcula el volumen de aire, medido en condiciones normales, que se necesita para quemar 2,5 L de octano de densidad 0,703 kg/L.
en volumen, calcula el volumen de aire, medido en condiciones normales, que se necesita para quemar 2,5 L de octano de densidad 0,703 kg/L.Datos: C = 12 ; O = 16 ; H = 1
-
El aluminio reacciona con el ácido clorhídrico dando cloruro de aluminio e hidrógeno. Se hacen reaccionar 100 g de una muestra de aluminio del
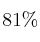 de pureza con ácido clorhídrico. Calcular:
de pureza con ácido clorhídrico. Calcular:a) El volumen de disolución del ácido clorhídrico 5 M necesario para la reacción.
b) El volumen de hidrógeno gaseoso obtenido medido a 27 ºC y 740 mm Hg.
Datos: Al = 27 ; Cl = 35,45 ; H = 1.
-
El cobre reacciona con ácido sulfúrico produciendo sulfato de cobre (II), dióxido de azufre y agua.
a) ¿Qué volumen de ácido sulfúrico al
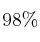 en peso y densidad 1,84 g/mL es necesario para obtener 100 L de dióxido de azufre, medidos en condiciones normales?
en peso y densidad 1,84 g/mL es necesario para obtener 100 L de dióxido de azufre, medidos en condiciones normales?b) ¿Cuántos gramos de un mineral que contiene un
 de pureza en cobre se necesitarán para obtener el volumen de dióxido de azufre anterior?
de pureza en cobre se necesitarán para obtener el volumen de dióxido de azufre anterior?


