Portada del sitio > Química - 2Bach > SELECTIVIDAD Junio 2015
SELECTIVIDAD Junio 2015
Todos los Ejercicios del Tema
Artículos de esta sección
-
100 g de bromuro de sodio,
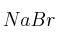 , se tratan con ácido nítrico concentrado,
, se tratan con ácido nítrico concentrado, 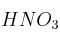 , de densidad 1,39 g/mL y riqueza
, de densidad 1,39 g/mL y riqueza  en masa, hasta reacción completa. En esta reacción se obtienen
en masa, hasta reacción completa. En esta reacción se obtienen 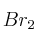 ,
, 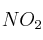 ,
, 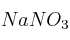 y agua como productos de la reacción.
y agua como productos de la reacción.
a) Ajusta las semirreacciones de oxidación y reducción por el método de ión-electrón y ajusta tanto la reacción iónica como la molecular.
b) Calcula el volumen de ácido nítrico necesario para completar la reacción.
Datos: Br = 80 ; Na = 23 ; O = 16 ; N = 14 ; H = 1
0 | 10


