SELECTIVIDAD Junio 2010
Artículos de esta sección
-
Solución
En un recipiente de 1 litro de capacidad, en el que previamente se ha hecho el vacío, se introducen 0,1 mol de NO, 0,05 moles de
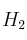 y 0,1 mol de agua. Se calienta el matraz y se establece el equilibrio:
y 0,1 mol de agua. Se calienta el matraz y se establece el equilibrio: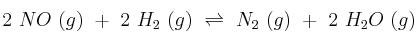
Sabiendo que cuando se establece el equilibrio la concentración de NO es 0,062 M, calcule:
a) La concentración de todas las especies en el equilibrio.
b) El valor de la constante
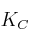 a esa temperatura.
a esa temperatura. -
Solución
Para la reacción:
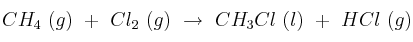
a) Calcule la entalpía de reacción estándar a 25 ºC, a partir de las entalpías de enlace y de las entalpías de formación en las mismas condiciones de presión y temperatura.
b) Sabiendo que el valor de
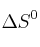 de la reacción es
de la reacción es 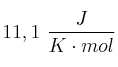 y utilizando el valor de
y utilizando el valor de 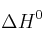 de la reacción obtenido a partir de los valores de las entalpías de formación, calcule el valor de
de la reacción obtenido a partir de los valores de las entalpías de formación, calcule el valor de 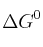 , a 25 ºC.
, a 25 ºC.Datos:
![\Delta H_f^0[CH_4(g)] = -74,8\ kJ/mol \Delta H_f^0[CH_4(g)] = -74,8\ kJ/mol](local/cache-TeX/aacee894b3b01c35842fad7192086cc5.png) ;
; ![\Delta H_f^0[CH_3Cl(l)] = -82,0\ kJ/mol \Delta H_f^0[CH_3Cl(l)] = -82,0\ kJ/mol](local/cache-TeX/8117f426f63cd1b532a95c3b70e0feea.png) ;
; ![\Delta H_f^0[HCl(g)] = -92,3\ kJ/mol \Delta H_f^0[HCl(g)] = -92,3\ kJ/mol](local/cache-TeX/93b4be883ef0b1159c41e5811c1c5477.png) . Entalpías de enlace en kJ/mol: (C-H) = 414 ; (Cl-Cl) = 243 ; (C-Cl) = 339 ; (H-Cl) = 432.
. Entalpías de enlace en kJ/mol: (C-H) = 414 ; (Cl-Cl) = 243 ; (C-Cl) = 339 ; (H-Cl) = 432.
0 | 10


