Portada del sitio > Química - 2Bach > 5 - Equilibrio Químico
5 - Equilibrio Químico
Todos los Ejercicios del Tema
Artículos de esta sección
-
Las concentraciones en el equilibrio de las especies de la reacciónSolución
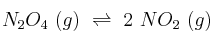 a 25 ºC, son 0,448 M para el reactivo y 0,0457 M para el producto. ¿Cuál es el rendimiento de la reacción?
a 25 ºC, son 0,448 M para el reactivo y 0,0457 M para el producto. ¿Cuál es el rendimiento de la reacción? -
En un reactor de 3,5 L y a 200 ºC se hace reaccionar nitrógeno e hidrógeno para dar amoniaco. En un momento determinado la composición del sistema es 0,249 moles deSolución
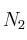 ,
, 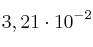 moles de
moles de 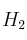 y
y 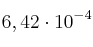 moles de
moles de 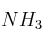 . Si la
. Si la 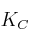 para la reacción a esa temperatura es 0,65, ¿habrá alcanzado el sistema el equilibrio? En caso de no estarlo, ¿hacia dónde evolucionará?
para la reacción a esa temperatura es 0,65, ¿habrá alcanzado el sistema el equilibrio? En caso de no estarlo, ¿hacia dónde evolucionará? -
Sabiendo que laSolución
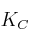 a 25 ºC para la formación del amoniaco vale
a 25 ºC para la formación del amoniaco vale 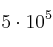 , calcula el valor de la nueva constante de equilibrio para una temperatura de 200 ºC, sabiendo que la variación de entalpía del proceso es -92 kJ.
, calcula el valor de la nueva constante de equilibrio para una temperatura de 200 ºC, sabiendo que la variación de entalpía del proceso es -92 kJ. -
Solución
En la reacción de formación del amoniaco, ¿cómo influirá un aumento de la temperatura en el rendimiento de la reacción?
Dato:
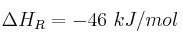
-
Se introducen, en un recipiente de 1,5 L, 0,300 moles deSolución
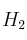 y 0,600 moles de
y 0,600 moles de 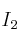 , a 350 ºC. Si la constante de equilibrio a esa temperatura es 38, ¿cuál es la concentración de cada especie en el equilibrio
, a 350 ºC. Si la constante de equilibrio a esa temperatura es 38, ¿cuál es la concentración de cada especie en el equilibrio 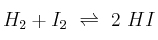 ?
? -
¿Qué efecto produce un aumento de presión en el equilibrio?Solución
¿Cómo evolucionará el equilibrio si se aumenta la temperatura?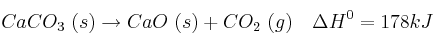
-
Para la reacción de disociación delSolución
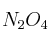 gaseoso,
gaseoso, 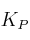 vale 2,49 atm a 60 ºC. Calcula el grado de disociación del
vale 2,49 atm a 60 ºC. Calcula el grado de disociación del 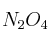 a 60 ºC y una presión total de 1 atm.
a 60 ºC y una presión total de 1 atm. -
En un recipiente de un litro, a 500 K, se introduce un mol de cloruro de nitrosilo (ClNO). Cuando se alcanza el equilibrio, el ClNO se encuentra disociado en unSolución
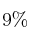 . Calcula, para la temperatura de 500 K, el valor de
. Calcula, para la temperatura de 500 K, el valor de 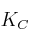 y
y 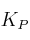 correspondiente al equilibrio:
correspondiente al equilibrio:
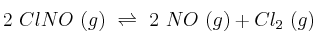
-
La constante de equilibrioSolución
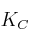 de la reacción:
de la reacción:
a 1650 ºC es 4,2. Determina la constante de equilibrio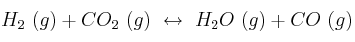
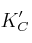 de la reacción:
de la reacción:
Razone su respuesta, escribiendo la expresión de las constantes de equilibrio en cada caso.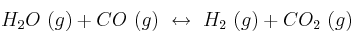
-
Solución
La constante de equilibrio
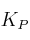 (a 25 ºC) vale
(a 25 ºC) vale 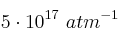 para el proceso:
para el proceso:
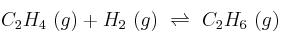
Calcula, a la misma temperatura, el valor de
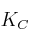 .
.
0 | 10


