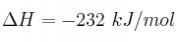Portada del sitio > Química - 1Bach > Q08 - Energía y Cinética de las Reacciones Químicas > Ej 2 de Entalpía de reacción
Ej 2 de Entalpía de reacción
A 25 ºC el nitrógeno reacciona con el oxígeno para formar dióxido de nitrógeno según el siguiente proceso: ![]() absorbiendo 8 030 cal/mol.
absorbiendo 8 030 cal/mol.
a) Escribe la ecuación termoquímica del proceso.
b) ¿Qué energía absorberá el sistema por cada mol de dióxido de nitrógeno que se obtenga?
c) ¿Cuántos julios se absorben en la obtención de 500 g de dióxido de nitrógeno?
(Datos: N = 14 ; O = 16 ; 1 cal = 4,18 J)
Vídeo de Teoría
Otros Ejerc. MODELO
 Ej 1 de Entalpía de reacción
Ej 1 de Entalpía de reacción
Un método muy usado en la industria para obtener el tetracloruro de carbono es: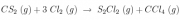
Calcula el calor que se desprende en la obtención de 100 g de tetracloruro de carbono.