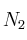Tanto el enlace iónico como el covalente hacen referencia a fuerzas interatómicas, es decir, son formas de "unirse" los átomos. La diferencia estriba en que cuando hablamos de compuesto iónico lo hacemos de redes (como si fueran infinitos átomos en el espacio) pero los compuestos covalentes moleculares NO son así. Imagina un compuesto covalente como el agua. La unión entre átomos es covalente (que es una fuerza de unión más fuerte que la iónica porque implica compartir electrones) pero, ¿cómo se forma el agua que bebemos? Ahí es donde debemos tener en cuenta las fuerzas intermoleculares, que son las fuerzas de cohesión entre las distintas moléculas de agua. Estas fuerzas son, en todos los casos, mucho menores que los valores de energía de los enlaces covalentes o iónicos entre átomos.
¿Queda ahora más claro? Espero que sí.
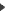 Ej 1 de Enlace químico. Enlace covalente
Ej 1 de Enlace químico. Enlace covalente
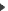 a)
a) 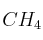
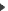 b)
b) 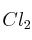
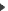 c)
c) 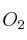
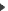 d)
d)